Производство серной кислоты
I. Сырьё, используемое для производства серной кислоты.
Основное сырьё
сера - S
серный колчедан (пирит) - FeS2
сульфиды цветных металлов - Cu2S, ZnS, PbS
сероводород – H2S
Вспомогательный материал
катализатор - оксид ванадия – V2O5
II. Подготовка сырья.
Разберём производство серной кислоты из пирита FeS2.
1) Измельчение пирита. Перед использованием большие куски пирита измельчают в дробильных машинах. Вы знаете, что при измельчении вещества скорость реакции увеличивается, т.к. увеличивается площадь поверхности соприкосновения реагирующих веществ.
2) Очистка пирита. После измельчения пирита, его очищают от примесей (пустой породы и земли) методом флотации. Для этого измельчённый пирит опускают в огромные чаны с водой, перемешивают, пустая порода всплывает наверх, затем пустую породу удаляют.
III. Основные химические процессы:
4FeS2 + 11O2 t = 800°C→ 2Fe2O3 + 8SO2 + Q или сжигание серы S + O2 t °C→ SO2
2SO2 + O2 400-500°С,V2O5,p↔2SO3 + Q
SO3 + H2O → H2SO4 + Q
IV. Технологические принципы:
- принцип непрерывности;
- принцип комплексного использования сырья, использование отходов другого производства;
- принцип безотходного производства;
- принцип теплообмена;
- принцип противотока (“кипящий слой”);
- принцип автоматизации и механизации производственных процессов.
V. Технологические процессы:
Принцип непрерывности: обжиг пирита в печи →поступление оксида серы (IV) и кислорода в очистительную систему →в контактный аппарат →подача оксида серы (VI) в поглотительную башню.
VI. Охрана окружающей среды:
1) герметичность трубопроводов и аппаратуры
2) газоочистительные фильтры
VII. Химизм производства:
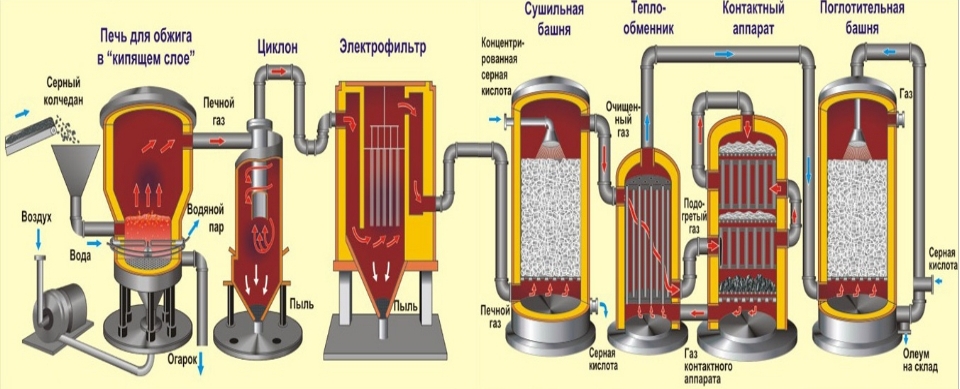
ПЕРВАЯ СТАДИЯ - обжиг пирита в печи для обжига в "кипящем слое".
Для получения серной кислоты используют, в основном, флотационный колчедан - отход производства при обогащении медных руд, содержащих смеси сернистых соединений меди и железа. Процесс обогащения этих руд происходит на Норильской и Талнахской обогатительных фабриках, которые и являются основными поставщиками сырья. Это сырье является более выгодным, т.к. серный колчедан добывают, в основном, на Урале, и, естественно, доставка его может быть очень дорогостоящей. Возможно использованиесеры, которая также образуется при обогащении руд цветных металлов, добываемых на рудниках. Поставщиками серы являются также ТОФ и НОФ. (обогатительные фабрики).
Уравнение реакции первой стадии
4FeS2 + 11O2 t = 800°C→ 2Fe2O3 + 8SO2 + Q
Измельчённый очищенный влажный (после флотации) пирит сверху засыпают в печь для обжига в "кипящем слое". Снизу (принцип противотока) пропускают воздух, обогащённый кислородом, для более полного обжига пирита. Температура в печи для обжига достигает 800°С. Пирит раскаляется до красна и находится в "подвешенном состоянии" из-за продуваемого снизу воздуха. Похоже это всё на кипящую жидкость раскалённо-красного цвета. В “кипящем слое” не слеживаются даже самые мелкие частицы пирита. Поэтому процесс обжига происходит очень быстро. Если раньше для обжига пирита требовалось 5-6 часов, то теперь - всего несколько секунд. Притом, в “кипящем слое” можно поддерживать температуру 800°С.
За счёт выделяющейся теплоты в результате реакции поддерживается температура в печи. Избыточное количество теплоты отводят: по периметру печи проходят трубы с водой, которая нагревается. Горячую воду используют дальше для центрального отопления рядом стоящих помещений.
Образовавшийся оксид железа Fe2O3 (огарок) в производстве серной кислоты не используют. Но его собирают и отправляют на металлургический комбинат, на котором из оксида железа получают металл железо и его сплавы с углеродом - сталь (2% углерода С в сплаве) и чугун (4% углерода С в сплаве).
Таким образом, выполняется принцип химического производства - безотходность производства.
Из печи выходит печной газ, состав которого: SO2, O2, пары воды (пирит был влажный!) и мельчайшие частицы огарка (оксида железа). Такой печной газ необходимо очистить от примесей твёрдых частиц огарка и паров воды.
Очистка печного газа от твёрдых частичек огарка проводят в два этапа - в циклоне (используется центробежная сила, твёрдые частички огарка ударяются о стенки циклона и ссыпаются вниз). Для удаления мелких частиц смесь направляем в электрофильтры, где идет очищение под действием тока высокого напряжения ~ 60000 В (используется электростатическое притяжение, частицы огарка прилипают к наэлектризованным пластинам электрофильтра, при достаточном накоплении под собственной тяжестью они ссыпаются вниз), для удаления паров воды в печном газе (осушка печного газа) используют серную концентрированную кислоту, которая является очень хорошим осушителем, поскольку поглощает воду.
Осушку печного газа проводят в сушильной башне - снизу вверх поднимается печной газ, а сверху вниз льётся концентрированная серная кислота. Для увеличения поверхности соприкосновения газа и жидкости башню заполняют керамическими кольцами.
На выходе из сушильной башни печной газ уже не содержит ни частичек огарка, ни паров воды. Печной газ теперь представляет собой смесь оксида серы SO2 и кислорода О2.
ВТОРАЯ СТАДИЯ – каталитическое окисление SO2 в SO3 кислородом в контактном аппарате.
Уравнение реакции этой стадии:
2SO2 + O2 400-500°С,V2O5,p ↔2SO3 + Q
Сложность второй стадии заключается в том, что процесс окисления одного оксида в другой является обратимым. Поэтому необходимо выбрать оптимальные условия протекания прямой реакции (получения SO3).
Из уравнения следует, что реакция обратимая, а, значит, на этой стадии необходимо поддерживать такие условия, чтобы равновесие смещалось в сторону выхода SO3, иначе нарушится весь процесс. Т.к. реакция идет с уменьшением объема (3V↔2V), то необходимо повышенное давление. Повышают давление до 7-12 атмосфер. Реакция экзотермическая, поэтому, учитывая принцип Ле-Шателье, при высокой температуре этот процесс вести нельзя, т.к. равновесие сдвинется влево. Начинается реакция при температуре = 420 градусов, но благодаря многослойности катализатора (5 слоев), мы можем ее повышать до 550 градусов, что значительно ускоряет процесс. Катализатор используют ванадиевый (V2O5). Он дешевый, долго служит (5-6 лет), т.к. наиболее устойчив к действию ядовитых примесей. Кроме того, он способствует сдвигу равновесия вправо.
Смесь (SO2 и O2) нагревается в теплообменнике и движется по трубам, между которыми в противоположном направлении проходит холодная смесь, которую надо нагреть. В результате происходит теплообмен: исходные вещества нагреваются, а продукты реакции охлаждаются до нужных температур.
ТРЕТЬЯ СТАДИЯ - поглощение SO3 серной кислотой в поглотительной башне.
А почему оксид серы SO3 не поглощают водой? Ведь можно было бы оксид серы растворить в воде: SO3 + H2O →H2SO4. Но дело в том, что если для поглощения оксида серы использовать воду, образуется серная кислота в виде тумана, состоящего из мельчайших капелек серной кислоты (оксид серы растворяется в воде с выделением большого количества теплоты, серная кислота настолько разогревается, что закипает и превращается в пар). Для того, чтобы не образовывалось сернокислотного тумана, используют 98%-ную концентрированную серную кислоту. Два процента воды - это так мало, что нагревание жидкости будет слабым и неопасным. Оксид серы очень хорошо растворяется в такой кислоте, образуя олеум: H2SO4·nSO3.
Уравнение реакции этого процесса:
nSO3 + H2SO4 → H2SO4·nSO3
Образовавшийся олеум сливают в металлические резервуары и отправляют на склад. Затем олеумом заполняют цистерны, формируют железнодорожные составы и отправляют потребителю.
